当疫苗成为全球各国对抗新冠疫情最重要的保护屏障,mRNA(messenger RNA,信使核糖核酸)这个极其专业的生物医学名词,开始在公众话题中高频出现,尽管普通人并非真的清楚这种疫苗起效的原理。
2020年12月,辉瑞和Moderna各自开发的mRNA新冠疫苗先后获得美国FDA的“紧急使用授权”批准,并于2021年8月获得FDA的全面上市批准。新冠疫情的到来让mRNA技术至少提前5至10年进入市场,并将疫苗从生物制品时代迅速带到化学制品时代。
除去斬获生物医药界最大IPO的Moderna,mRNA疫苗相关概念的创业公司也在飞速发展,争取上市机会。在中国,近两年出现了十余家深入这个领域探索mRNA疫苗的公司。
这些公司的一个显著共性就是“非常年轻”。目前国内自主研发新冠mRNA疫苗并已处于临床试验阶段的企业有3家,其中进展最快的艾博生物和珠海丽凡达公司皆成立于2019年,另一家在老挝进入II期临床试验的斯微生物则创立于2016 年。
一位在医药产业有20年从业经历的制药人感慨,他从未在业内见过成长如此之快的一批公司—无论是研发进展、公司估值,还是产品申请注册的速度。
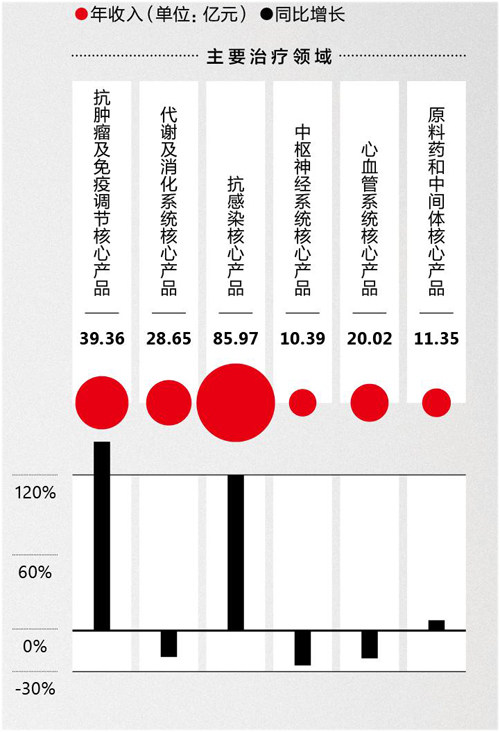
复星医药2021年主要治疗领域核心产品销售收入情况
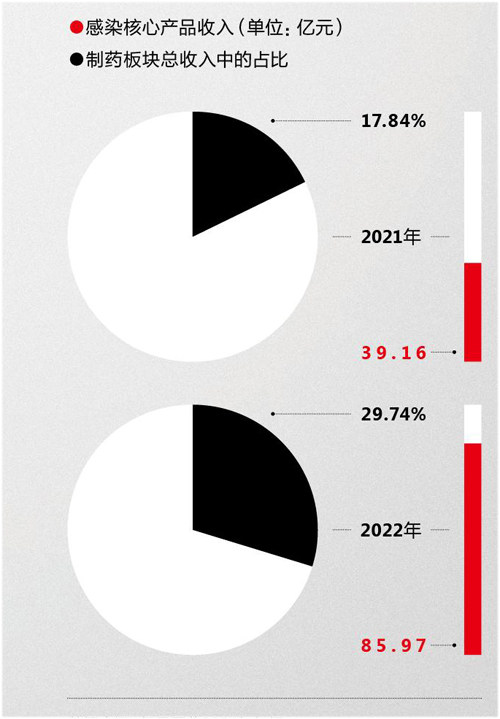
抗感染核心产品在复星医药制药板块总收入中的占比变比
当下,面对传染力更强的奥密克戎毒株,新冠疫苗的接种价值被提升到一个前所未有的高度。特别是以基因技术为载体的核酸疫苗(mRNA疫苗和DNA疫苗)被视为未来走向开放的解药。
在公众认知中,复星医药从BioNTech引进的mRNA疫苗“复必泰”在所有候选者中最为瞩目。外界一度认为,鉴于BioNTech与辉瑞合作的mRNA疫苗在欧美投入使用后已证明了有效性和安全性,复必泰应该会是“最有可能首批在国内上市”的直接引进类型的mRNA疫苗。但事实并没有这么简单,国家相关监管机构没有为复必泰的上市注册申请开绿灯。
最先冲过“获批上市”这道终点线的mR NA疫苗,极有可能是一家经过两年多筹备、依靠自主研发路径一路闯关的中国公司。如果从“新冠核酸疫苗”的范畴来看,艾博生物的mRNA疫苗以及艾棣维欣的DNA疫苗都已经走到了三期临床阶段,是距离上市注册申请最近的两个产品。
“当时不知道新冠会流行多久,也不知道它的市场空间和价值有多大。最直接的动力并不是来自于很明确的市场预期,而是说借助疫情的暴发和对疫苗的需求,去突破一些新的技术。”艾棣维欣执行董事张璐楠对《第一财经》杂志说。在新冠疫情之前,艾棣维欣的疫苗研发项目针对的是会引发肺部和呼吸道感染的呼吸道合胞病毒(RSV),这也是全球在肺炎疫苗领域最关注的品种之一。但彼时国内并没有一套针对DNA疫苗人体临床试验的标准体系可用以考核产品的有效性和安全性,所以企业只能摸着石头过河。有利的条件在于,新冠疫情在武汉最先被发现,因此早期中国对疫苗的研发条件也相对最为充分。
部分中国企业研发及生产mRNA新冠疫苗的进展

过去两年,国家药品监督管理局(NMPA)仅公开批复了3家企业的mRNA新冠疫苗和1家DNA新冠疫苗进入临床试验。但今年4月上旬,国内两家制药上市公司—石药集团和康希诺生物接连发布公告,宣布其新冠mRNA疫苗研发获得NMPA的临床试验批件(IND)。外界很容易将监管机构对新冠疫苗审批的提速,与3月以来全国多地暴发的奥密克戎疫情联系到一 起。
4月中旬,国药北京生物、武汉生物和北京科兴生物的3款国产新冠奥密克戎株灭活疫苗,也各自宣布已在香港获批开展临床试验。由此可见,要应对汹涌袭来的变异株,事关寻找“更好的疫苗”的竞赛仍未结束。
复必泰悬而未决
3月22日,身背“疫苗股”标签已两年有余的复星医药发布2021年全年财报。在当日举行的线上业绩说明会上,与复星发言人一贯的论调相同,复星国际执行董事、联席CEO陈启宇继续表示复必泰的审批工作“一直在积极的沟通反馈交流之 中”。
按照复星医药董事长兼C EO吴以芳的公开说法,早在2020年1月武汉因发现不明肺炎而被迫封城的当天,复星就决定要为这场疫情寻找“最好的疫苗”。同年3月,复星医药公告称,将向BioNTech支付至多8500万美元的许可费,获授权在中国内地及港澳台独家开发、商业化BioNTech的mRNA新冠疫苗。
2020年11月13日,复星公告称其引进的mRNA疫苗获中国国家药品监督管理局临床试验批准。










